 Notícias do ano! Pesquisadores do Instituto Wyss de Harvard, Universidade de Harvard, EUA, desenvolveram e testaram uma vacina personalizada e revolucionária contra o câncer agressivo.
Notícias do ano! Pesquisadores do Instituto Wyss de Harvard, Universidade de Harvard, EUA, desenvolveram e testaram uma vacina personalizada e revolucionária contra o câncer agressivo.
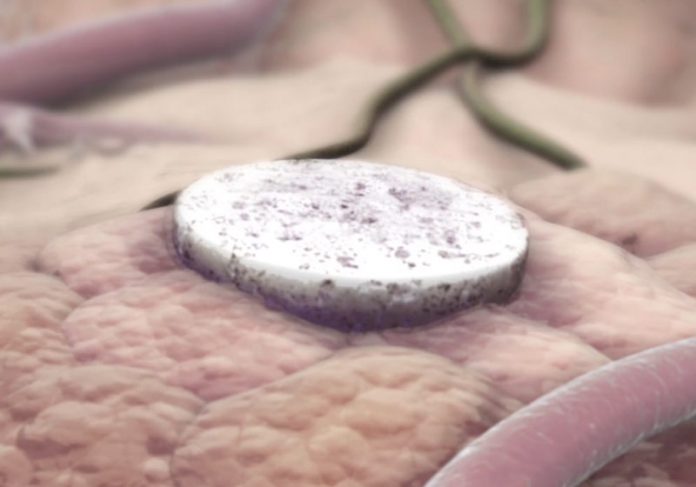
Chamada de vacina “implantável”, do tamanho de uma aspirina, ela fica próxima ao local do tumor e impede a quimioterapia em todo o corpo. E uma vez aplicado, ele reprograma o sistema imunológico para atacar as células cancerosas, não apenas naquele local, mas em todo o corpo.
A nova vacina é baseada em biomateriais e combina quimioterapia e imunoterapia para tratar tumores resistentes. Foi testado em ratos e “100% sobreviveu”.
“100% dos ratos que receberam a vacina em gel sobreviveram sem metástases, enquanto todos os ratos não tratados morreram”, diz o relatório da universidade.
“A capacidade desta vacina de induzir fortes respostas imunológicas sem a necessidade de identificar antígenos de pacientes específicos é uma grande vantagem, assim como a capacidade da administração de quimioterapia local de contornar os efeitos colaterais graves da quimioterapia sistêmica, o único tratamento disponível atualmente para a doença”, disse Robert P. Pinkas. , um dos autores e líder da plataforma de Immuno-Materials do Wyss Institute.
“Esta vacina não apenas ativa as células dendríticas com TAA específico do tumor in situ, mas também reorganiza o microambiente tumoral para permitir ao sistema imunológico um maior acesso ao tumor e cria uma memória imunológica que evita novas recorrências.”
“O câncer de mama triplo-negativo não estimula respostas fortes do sistema imunológico e as imunoterapias existentes não conseguiram tratá-lo. Em nosso sistema, a imunoterapia atrai várias células imunológicas para um tumor, enquanto a quimioterapia cria um grande número de fragmentos de células cancerosas mortas que as células imunológicas podem pegar e usar para gerar uma resposta específica do tumor eficaz “, explicou o co-primeiro. Autor Hua Wang, ex-pós-doutorado em Harvard e atual professor assistente no Departamento de Ciência e Engenharia de Materiais da Universidade de Illinois, Urbana-Champaign.
Vacina personalizada
Desenvolvida pela primeira vez em 2009, a vacina injetável contra o câncer tem se mostrado muito promissora no tratamento de vários tipos de câncer em camundongos e foi investigada em ensaios clínicos para o tratamento de melanoma no Dana Farber Cancer Institute.
“A implantação de drogas quimioterápicas dentro da estrutura da vacina cria uma explosão de morte de células cancerosas que libera TAA diretamente do tumor em células dendríticas, evitando o longo e caro processo de desenvolvimento de antígenos”, disse o coautor Alex Najibi, graduado em SEAS no laboratório de David Mooney.
Na formulação original da vacina, as moléculas encontradas nas células cancerosas – chamadas antígenos associados ao tumor (TAAs) – são incorporadas junto com os adjuvantes em uma estrutura do tamanho de uma aspirina para que as células dendríticas recebidas possam reconhecê-las como “estranhas” e montar uma resposta imune dirigida contra o tumor.
Esses TAAs podem ser isolados de tumores que foram colhidos ou identificados pelo sequenciamento do genoma de células cancerígenas e subsequentemente produzidos, mas ambos os métodos para criar vacinas contra o câncer personalizadas podem ser demorados, tediosos e caros.
Testes
Wang, Najibi e seus colegas decidiram aplicar essa nova tática de vacina contra o câncer para o TNBC, uma doença na qual os tumores suprimem agressivamente a atividade imunológica em sua área local, limitando a eficácia da imunoterapia.
A equipe carregou primeiro seu algoritmo de hidrogel de alginato com uma molécula de proteína chamada fator estimulador de colônia de granulócitos e macrófagos (GM-CSF).
O GM-CSF estimula o desenvolvimento e a concentração de células dendríticas, que capturam antígenos de tumores e outros agressores e os apresentam às células T nos gânglios linfáticos e baço para desencadear uma resposta imunológica.
Eles também adicionaram o quimioterápico doxorrubicina (Dox) associado a um peptídeo chamado iRGD. IRGD é conhecido por penetrar em tumores e ajudar a direcionar Dox para tumores após a liberação.
Quando camundongos com tumores TNBC foram injetados com a nova vacina, aqueles que receberam uma estrutura carregada com GM-CSF e conjugado Dox-iRGD mostraram uma penetração de drogas significativamente melhor nos tumores, aumento da morte celular e menos tumores pulmonares metastáticos. do que aqueles que receberam géis contendo Dox conjugado a uma molécula de peptídeo codificado, Dox não modificado ou não tratado.
A análise mostrou que eles haviam acumulado um grande número de células dendríticas, indicando que os componentes imunoterápicos e quimioterápicos da vacina estavam ativos.
O terceiro componente
Impulsionada pelos resultados, a equipe experimentou adicionar um terceiro componente a uma vacina chamada CpG, uma sequência de DNA bacteriano sintético conhecido por aumentar a resposta imunológica.
Os ratos que receberam vacinas com este suplemento mostraram um crescimento tumoral significativamente mais lento e tempos de sobrevivência mais longos do que os ratos que receberam as vacinas sem ele.
Para avaliar a força e a especificidade da resposta imunológica gerada por esta vacina de três partes, os pesquisadores extraíram e analisaram células dos gânglios linfáticos e baço dos animais. Surpreendentemente, 14% das células T retiradas dos gânglios linfáticos reagiram contra as células tumorais, indicando que as células dendríticas as “treinaram” para atacar o câncer, em comparação com apenas 5,3% dos camundongos que receberam a vacina de duas partes e 2,4% da vacina T células de camundongos não tratados.
Além disso, administrar uma dose de “reforço” da vacina 12 dias após a injeção aumentou ainda mais o tempo de sobrevivência.
Ação localizada
Embora esses resultados revelem o efeito da vacina na ativação do sistema imunológico, a equipe também queria entender como ela afeta o microambiente local do tumor.
A análise das vacinas e de seus tumores próximos revelou que as células tumorais tratadas com géis contendo GM-CSF, Dox-iRGD e CpG tinham uma quantidade aumentada de proteína calreticulina em suas superfícies, um indicador de morte celular.
Os camundongos que receberam a vacina de três partes também mostraram um número maior de macrófagos pró-inflamatórios: leucócitos que foram associados a melhor atividade anticâncer e maior sobrevida.
Os pesquisadores também descobriram que o tratamento causou um aumento na expressão da proteína de superfície PD-L1 em células tumorais, que o câncer usa para prevenir a detecção imunológica.
Eles tinham um palpite de que o tratamento concomitante com um inibidor de checkpoint anti-PD-1 que bloqueava esta vacina de imunidade para evitar aumentaria sua eficácia.
Os camundongos foram implantados com uma vacina de três partes e, em seguida, injetados separadamente com anti-PD-1.
Os camundongos tratados com uma combinação de vacina em gel e anti-PD-1 mostraram tamanho e número de tumor significativamente reduzidos e sobreviveram em média 40 dias em comparação com 27 dias para camundongos não tratados e 28 dias para camundongos que receberam anti-PD. PD-1 apenas.
Essa sinergia sugere que a vacina poderia ser melhor usada em combinação com terapias com inibidores de checkpoint.
Para imitar a forma como uma vacina contra o câncer pode ser administrada a pacientes humanos, a equipe testou sua capacidade de prevenir a recorrência do câncer após a remoção de um tumor primário.
Eles excisaram cirurgicamente tumores de camundongos TNBC e então injetaram sua vacina de hidrogel de três partes ou vacina líquida que continha todos os componentes em suspensão perto do local original do tumor.
Ambos os grupos de tratamento tiveram significativamente menos recorrências de tumor, mas a vacina em gel criou um crescimento tumoral significativamente mais lento e melhorou a sobrevivência.
Próximos passos
A equipe continua a explorar a combinação de quimioterapia e vacinas contra o câncer e espera melhorar sua eficácia antitumoral para outros modelos de tumor de difícil tratamento.
Ele espera conduzir estudos futuros para melhor compreender e otimizar o sistema para que progrida em testes pré-clínicos e, por fim, em pacientes humanos.
Este trabalho foi financiado pelo National Institutes of Health, pela Wyss Scholarship for Technological Development e pela National Science Foundation.
